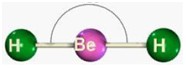
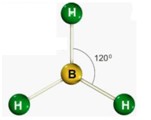
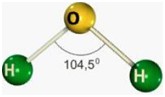
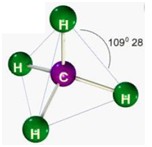
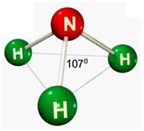
segunda-feira, 18 de junho de 2012
SAIBA MAIS
O que é química?
Ciência quer dizer conhecimento em latim, sendo assim, a Química é o
conhecimento ou a ciência que estuda as propriedades e as transformações
que ocorrem na matéria e a energia acorrida nesses processos.
A Química está presente em nosso dia a dia, como por exemplo, nos
medicamentos, nas pilhas e baterias, nos processos de corrosão.
Como a química é dividida?
A Química é dividida em: Química orgânica – ciência que estuda as propriedades da composição e das reações químicas dos compostos organidos do carbono.
Química Inorgânica – ciência que estuda as propriedades da composição e das reações químicas dos demais compostos elementos químicos.
Físico-Química – ciência que estuda questões químicas relacionadas à Física.
Química Analítica – ciência que analisa amostras químicas para descobrir sua composição estrutural e quantidade de elementos químicos.
Físico-Química
O que é físico-química?

A Físico-Química é a ciência que nos proporciona
instrumentos para interpretar e dominar os fenômenos naturais. Na base
dessa ciência encontram-se os princípios fundamentais da termodinâmica,
classicamente ensinados a partir do comportamento dos sistemas
macroscópicos.
Ela também compreende a física, sendo a disciplina que estuda as
propriedades físicas e químicas da matéria, através da combinação de
duas ciências: a física, onde se destacam áreas como a termodinâmica e a
mecânica quântica, e a química. Suas funções variam desde
interpretações das escalas moleculares até observações de fenômenos
macroscópicos.
A Físico-química moderna possui áreas de estudo importantes como a
termoquímica, cinética química, química quântica, mecânica estatística e
química elétrica. A Físico-química também é fundamental para a ciência
dos materiais.
Para Refletir
"Qualquer um que não se choque com a
Mecânica Quântica é porque não a entendeu."
(Niels Bohr)
"Fé e razão são como a dualidade-onda partícula:pode-se ter as duas coisas, mas nunca ao mesmo tempo."
(Alberto Präss)
Química Quântica
A Química quântica estuda conceitos relacionados aos elétrons presentes na eletrosfera de um átomo. Essa ciência tem como base os princípios da mecânica quântica, foram eles que inspiraram o pesquisador Werner Heisenberg (1901-1976) a propor um modelo quântico para o átomo.


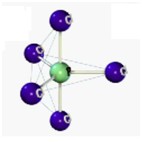
Antes de introduzir o conceito de Heisenberg, observe a eletrosfera de um átomo:

Com base na imagem acima podemos afirmar que:
- A eletrosfera, onde estão localizados os átomos, circula todo o núcleo atômico (composto por prótons e nêutrons);
- Os elétrons estão em movimento constante demonstrado pelas órbitas (anéis azuis).
Daria para saber onde exatamente um elétron se posiciona na eletrosfera? É claro que não, uma vez que estão sempre em movimento de rotação ao redor do núcleo.
Foi baseado neste questionamento que Heisenberg criou o "Princípio da Incerteza" onde, como o próprio nome sugere, não se pode afirmar que exista uma órbita definida para o elétron. No mesmo parâmetro introduziu o conceito de Orbitais: local onde existe a maior probabilidade de se encontrar um elétron.
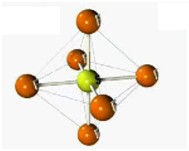
Orbitais são considerados como nuvens onde se localizam os elétrons. Como a eletrosfera se localiza ao redor do núcleo, imagine os orbitais como sendo nuvens eletrônicas que circulam a parte central do átomo. Para um melhor entendimento, considere a ilustração:

No desenho acima, os orbitais são representados pelas formas ovais roxas e azuis. Repare que o núcleo do átomo é caracterizado pela presença das esferas amarela e rosa (prótons e nêutrons).
Referência: http://www.brasilescola.com/quimica/quimica-quantica.htm
Referência: http://www.brasilescola.com/quimica/quimica-quantica.htm
domingo, 17 de junho de 2012
Macete - Tabela Periódica
Metais Alcalinos
Uso: Para lembrar elementos da tabela periódica da família dos alcalinos: Li, Na, K,Rb,Cs,Fr
Macete: "Li Na Kartilha Robinson Crusoé Francê = Li, Na, K,Rb,Cs,Fr"
Metais Alcalinos Terrosos
Uso: Para lembrar a familia dos alcalinos terrosos: B, Mg, Ca, Sr, Ba, Ra
Macete: "Bela Magrela Casou-se com o Senhor BaRão = B, Mg, Ca, Sr, Ba, Ra"
Macete: "Bela Magrela Casou-se com o Senhor BaRão = B, Mg, Ca, Sr, Ba, Ra"
Elementos da Tabela Periódica
NOME DOS COMPOSTOS QUIMICOS (Familia 1a à 8a)
1A - LiNaK Robou Césio da França
Li- lítio, Na - sódio, K - potássio, Rb -rubídio, Cs - césio, Fr - francio
2A - Bela e Magnifica Casa do Sr BaRao
Be - berilio, Mg - magnesio, Ca - calcio, Sr - estroncio, Ba - bario, Ra -radio
3A - Belas Alunas Galinhas Indo Telefonar
B - boro, Al - aluminio, Ga - galio, In - indio, Tl-telurio
4A - Casou Silicia Germana com Senador Paraibano ou Como a Simone Gerimunda Somente Pela Bunda!C - Carbono, Si - Silicio, Ge - germanio, Sn - estanho, Pb - chumbo
5A - Nossos Pais Assam Saborosos Bifes
N - nitrogenio, P - fosforo, As - astato, Sb-antimonio, Bi - bismuto
6A - Os Sete Poloneses
O - oxigenio, S - enxofre, Se - selenio, Te - telurio, Po- polonio
7A - Fiat Claro Branco Inteiramente Atolado ou Foi Clóvis Bornai que Incendiou Atenas!
F - fluor , Cl - cloro, Br - bromo, I - iodo, At - astato
8A - Helio Nem Argumentou Kravou Xereca da Rainha ou Helio Negou Armas de Kriptonita ao Xerife Radonio
He - helio, Ne - neonio, Ar - argonio, Kr - kriptonio, Xe - xenonio, Rd - radonio
Tabela de Linus Pauling
Uso: Para gravar a ordem da tabela de Linus Pauling: S, P, D, F:
Macete: Sapo Pula Dando Facadas,
Sebastião Pereira De Freitas,
Sepultura Para Defunto Fresco
Supercondutores
Sem dúvida uma inovação tecnológica que irá mudar e melhorar a vida de todo o planeta, porém, os custos ainda são muito altos.
Revista #1
Estamos lançando hoje, a primeira edição de nossa revista, com parceria do pessoal do quimicafatal.blogfatal.com ! Confira online em: http://www.myebook.com/index.php?option=ebook&id=133697
sábado, 16 de junho de 2012
Radiação
O que é radiação?
É
uma forma de transmissão de energia à distância que acontece de duas
maneiras diferentes: ou por meio de pequenas partículas que se deslocam
com grande velocidade, ou por ondas de natureza eletromagnéticas
similares a luz. A radiação de natureza particulada é caracterizada por
sua carga, massa e velocidade: pode ser carregada ou neutra, leve ou
pesada, lenta ou rápida. Prótons, nêutrons e elétrons ejetados de átomos
ou núcleos atômicos são exemplos de radiação particulada. A radiação
eletromagnética é constituída por campos elétricos e magnéticos variando
no espaço e no tempo.
- Radiações eletromagnéticas: luz, microondas, infravermelho, ondas de rádio, radar, laser, raios X, radiação gama;
- Radiações sob forma de partículas (com massa, carga elétrica, carga magnética mais comum): feixes de elétrons, os feixes de prótons, radiação beta, radiação alfa.E radioatividade?
Está associada diretamente ao núcleo do átomo, na qual ao final do
processo de reação o núcleo sofre alteração.
Ao contrário da reação química em que o núcleo permanece inalterado,sofrendo mudanças apenas na eletrosfera do átomo. Por isso, é importante que você perceba a diferença entre uma reação química e uma reação nuclear. Já uma reação nuclear, por sua vez, provocará alterações no núcleo do átomo, fazendo-o com que se transforme em outros elementos e emita raios alfa, beta e/ou gama.Os elementos químicos que emitem radiações sob forma de partículas são chamados de elementos radioativos.O que é radiação ionizante? São as radiações que produzem íons, radicais e elétrons livres na matéria que sofreu a interação. A ionização se deve ao fato das radiações possuírem energia alta, o suficiente para quebrar as ligações químicas ou expulsar elétrons dos átomos após colisões.
APLICAÇÕES DAS RADIAÇÕES
Radioterapia – Consistem na utilização da radiação gama, raios X ou feixes de elétrons para o tratamento de tumores, eliminando células cancerígenas e impedindo o seu crescimento. O tratamento consiste na aplicação programada de doses elevadas de radiação, com a finalidade de atingir as células cancerígenas, causando o menor dano possível aos tecidos sãos intermediários ou adjacentes.
O que é Raio-X? É radiação eletromagnética com comprimento de onda de 10-11 a 10-8 m (0,1 a 100 Å), resultante da colisão de elétrons produzidos em um catodo aquecido contra eletrons de anodo metálico.
A radiografia é uma imagem obtida, por um feixe de raios X ou raios gama que atravessa a região de estudo e interage com uma emulsão fotográfica ou tela fluorescente. As doses absorvidas de radiação dependem do tipo de radiografia. Como existe a acumulação da radiação ionizante não se devem tirar radiografias sem necessidade e, principalmente, com equipamentos fora dos padrões de operação. Para evitar exposição desnecessária, deve-se ficar no momento do disparo do feixe, protegido por um biombo com blindagem de chumbo.Radioisótopos – Existem terapias medicamentosas que contêm radioisótopos que são administrados ao paciente por meio de ingestão ou injeção, com a garantia da sua deposição preferencial em determinado órgão ou tecido do corpo humano. Por exemplo, isótopos de iodo para o tratamento do cancro na tiróide.
Mapeamento com radiofármacos – Tem o objetivo de marcar moléculas de substâncias que se incorporam ou são metabolizadas pelo organismo do homem, de uma planta ou animal. Por exemplo, o iodo-131 é usado para seguir o comportamento do iodo -127, estável, no percurso de uma reação química in vitro ou no organismo. Nestes exames, a irradiação da pessoa é inevitável, mas deve-se ter em atenção para que esta seja a menor possível.
Irradiação de alimentos – Apesar da água e alguns alimentos conterem radioisótopos (em baixas quantidades), é possível utilizar a técnica de radiação para conservação dos alimentos. A irradiação pode impedir a multiplicação de microrganismos que causam a deterioração do alimento, tais como bactérias e fungos, pela alteração de sua estrutura molecular, como também inibir a maturação de algumas frutas e legumes, através de alterações no processo fisiológico dos tecidos da planta.
Gamagrafia – Consiste na impressão da radiação gama em filme fotográfico. Podem ser usadas para revelar algum equipamento quebrado dentro de uma máquina ou uma tubulação rompida de um oleoduto; as empresas de avião realizam impressões constantes para verificar se há rachaduras nas partes metálicas e soldas.
Arqueologia – Pesquisadores utilizam o carbono-14 (isótopo do carbono) para fazer a datação de fósseis de madeira, papiros e animais de valor histórico. O carbono-14 resulta da absorção continua de neutrons dos raios cósmicos pelos átomos de nitrogênio, que ao se combinar com o oxigênio forma o gás carbônico (14CO2), que é absorvido pelas plantas durante a fotossíntese. O 14C tem meia-vida de 5730 anos, o que permite a medição desse material na amostra, ‘sabendo’ a possível idade da mesma.
EXPOSIÇÃO A RADIAÇÃO
Com a repercussão da II Guerra Mundial, na cidade de Hiroshima, Japão, a cidade foi destruída e 90 mil pessoas morreram no mesmo dia. Três dias após o primeiro ataque, outro avião atacou a cidade de Nagasaki. O ataque resultou em mortes imediatas de 40 mil pessoas. Doze horas depois do ataque, ainda era possível ver o fogo na cidade de Nagasaki. Até o final de 1945, cerca de 210 mil pessoas tinham morrido nas cidades de Hiroshima e Nagasaki, e outras milhares sofreram ferimentos sérios de queimaduras e os efeitos da radiação pós exposiçãoA exposição à radiação ionizante pode danificar nossas células e afetar o nosso material genético (DNA), causando doenças graves, levando até a morte.
São basicamente três fatores que podem gerar complicações devido a exposição a radiação: tempo de meia vida do elemento radioativo; tempo de exposição e dose do material radioativo.
UM POUCO DE HISTÓRIA…
Em meados de 1896, o físico W.C. Roentgen (1845-1923) descobriu raios capazes de atravessar diferentes materiais e escurecer filmes fotográficos, batizando os mesmos de Raios-X. Estes são produzidos quando uma máquina acelera elétrons e os faz colidir contra uma placa de chumbo, ou outro material. Na colisão, os elétrons perdem a energia cinética, ocorrendo uma transformação em calor (quase a totalidade) e um pouco de raios-X. Estes raios atravessam corpos que, para a luz habitual, são opacos. O expoente de absorção deles é proporcional à densidade da substância. Por isso, é possível obter uma fotografia dos órgãos internos do homem com os raios-X.¥ Em 1896, Becquerel, descobriu a radioatividade, através de experimentos baseados na “sensibilização” de filmes fotográficos quando expostos a sais de urânio. Ou seja, o urânio emitia radiações invisíveis, que seriam radiações de partículas.¥ Com o feito, o casal Curie, após anos de estudo e experimentações, descobriram os elementos Rádio e Polônio, ambos radioativos.¥ Na época em que J. J. Thomson propôs seu modelo (1904), H. Geiger e E. Marsden estudavam o espalhamento de feixes bem colimados de partículas alfa, que já se sabia serem núcleos de átomos de hélio, por finas folhas de ouro, hoje se conhece esse experimento como o de Rutherford (1911).¥ Com a descoberta de Rutherford (átomos divisíveis, com núcleo denso e pequeno, elétrons girando ao redor do núcleo), a teoria atômica de Dalton e Thomson faziam parte do passado.¥ Outros estudos surgiram, Física Quântica, para explicar melhor a composição do átomo, bem como sua estrutura. Isto foi possível com contribuições de vários cientistas: Bohr, De Broglie, Max Plank, Heisenberg, Sommerfeld, dentre outros.¥ Em 1939, o mundo conhece a bomba atômica, cujo funcionamento envolve a energia proveniente dos núcleos de átomos radioativos, construída pelo cientistas J. Robert Oppenheimer (1904-1967), conhecido com o ‘pai da bomba’, e mais um grupo de cienistas, dentre os quais destaca-se: Niels Bohr (1885-1962); Albert Einstein (1879-1955), com sua Teoria da Relatividade e criação da clássica fórmula (e = m.c²), com o movimento de corpos com pequena quantidade de matéria, com velocidade próximos a da luz, que é de aproximadamente trezentos mil quilômetros por segundo, pode-se gerar uma quantidade enorme de energia com uma pequena quantidade de massa; Enrico Fermi (1901-1954), construiu em 1941 um reator nuclear em uma quadra de squash na Universidade de Chicago, dentre tantos outros.¥ A partir dos efeitos de uso da bomba atômica contra a humanidade, foi criado o Tratado de não Proliferação nuclear (TNP) e o avanço nos estudos para aplicações benéficas da energia proveniente dos núcleos instáveis.
Experiências
Concentração dos Reagentes - Permanganato e Água Oxigenada
Referência: http://www.youtube.com/watch?v=l7vXz2ZB_NI
Radioatividade
A radioatividade é definida como a capacidade que alguns elementos
fisicamente instáveis possuirem a capacidade de emitir energia sob forma de partículas
ou radiação eletromagnética.
A radioatividade foi descoberta no século XIX. Até esse momento
predominava a ideia de que os átomos eram as menores partículas da
matéria. Com a descoberta da radiação, os cientistas constataram a
existência de partículas ainda menores que o átomo, tais como: próton,
nêutron, elétron. Vamos rever um pouco dessa história?
- No ano de 1896, o físico francês Antoine-Henri Becquerel (1852-1908)
observou que um sal de urânio possuía a capacidade de sensibilizar um
filme fotográfico, recoberto por uma fina lâmina de metal.
- Em 1897, a cientista polonesa Marie Sklodowska Curie (1867-1934) provou que a intensidade da radiação é sempre proporcional à quantidade do urânio empregado na amostra, concluindo que a radioatividade era um fenômeno atômico.
- Em 1897, a cientista polonesa Marie Sklodowska Curie (1867-1934) provou que a intensidade da radiação é sempre proporcional à quantidade do urânio empregado na amostra, concluindo que a radioatividade era um fenômeno atômico.
Anos se passaram e a ciência foi evoluindo até ser possível produzir a
radioatividade em laboratório. Veja a diferença entre radiação natural e
artificial:
• Radioatividade natural ou espontânea: é a que se manifesta nos elementos radioativos e nos isótopos que se encontram na natureza.
• Radioatividade artificial ou induzida: é aquela produzida por transformações nucleares artificiais.
• Radioatividade artificial ou induzida: é aquela produzida por transformações nucleares artificiais.
A radioatividade geralmente provém de isótopos como urânio-235, césio-137, cobalto-60, tório-232, que são fisicamente instáveis e radioativos, possuindo uma constante e lenta desintegração. Tais isótopos liberam energia através de ondas eletromagnéticas (raio gama) ou partículas subatômicas em alta velocidade: é o que chamamos de radiação. O contato da radiação com seres vivos não é o que podemos chamar de uma boa relação.
Os efeitos da radiação podem ser em longo prazo, curto prazo ou
apresentar problemas aos descendentes da pessoa infectada (filhos,
netos). O indivíduo que recebe a radiação sofre alteração genética, que
pode ser transmitida na gestação. Os raios afetam os átomos que estão
presentes nas células, provocando alterações em sua estrutura. O
resultado? Graves problemas de saúde como a perda das propriedades
características dos músculos e da capacidade de efetuar as sínteses
necessárias à sobrevivência.
A radioatividade pode apresentar benefícios ao homem e por isso é utilizada em diferentes áreas. Na medicina, ela é empregada no tratamento de tumores cancerígenos; na indústria é utilizada para obter energia nuclear; e na ciência tem a finalidade de promover o estudo da organização atômica e molecular de outros elementos.
A radioatividade pode apresentar benefícios ao homem e por isso é utilizada em diferentes áreas. Na medicina, ela é empregada no tratamento de tumores cancerígenos; na indústria é utilizada para obter energia nuclear; e na ciência tem a finalidade de promover o estudo da organização atômica e molecular de outros elementos.
Eletroquímica
O que é Cela Galvânica e Cela Eletrolítica?
Denomina-se cela(ou célula) Galvânica um dispositivo no qual a
ocorrência espontânea de uma reação permite a geração de corrente.
Reação não espontânea para forçar a ocorrência de uma reação que não ocorre espontaneamente, mas que é de interesse prático. Essa reação é denominada Eletrólise e o dispositivo chamado Cela Eletrolítica.
Concentração em Quantidade de Matéria
A concentração em quantidade de matéria consiste na relação entre a quantidade de matéria do soluto, expressa em mols, e o volume da solução em litros.
Dessa forma, a concentração em quantidade de matéria indica a
quantidade de matéria presente em um litro da solução; por isso sua
unidade é mol/L.
Essa grandeza das soluções químicas também é denominada molaridade, concentração molar, ou, ainda, concentração em mol/L.
Essa última expressão e a que está sendo usada no título deste texto
são as formas recomendadas pela IUPAC (União Internacional da Química
Pura e Aplicada) e pelo SI (Sistema Internacional de Unidades).
Matematicamente, temos:
No entanto, em alguns problemas a quantidade de matéria é expressa em
gramas e não em mol. Assim, é necessário fazer as devidas conversões ou
utilizar a seguinte fórmula matemática deduzida abaixo:
- Sabendo que a fórmula da quantidade de matéria (n1) é dada por:
n1 = m1
M1
M1
Onde:
m1= massa em gramas do soluto;
M1= massa molar do soluto em gramas por mol (g/mol).
M1= massa molar do soluto em gramas por mol (g/mol).
- Substituindo n1 na fórmula da concentração em mol/L, temos:
C = n1
V
V
CURIOSIDADES
O que é uma solução aquosa?
É qualquer solução em que o solvente é a água, exemplo sal de cozinha
dissolvido em água é uma solução aquosa de cloreto de sódio.
Qual a diferença entre concentração comum e densidade?
Concentração comum é a relação apenas entre o soluto e o solvente. Já a
densidade é a relação existente entre a massa e o volume ocupado por
determinada substância.
CURIOSIDADES
Por que os átomos se ligam?
Durante uma ligação química, os átomos liberam uma quantidade de
energia, o que demonstra que os átomos ligados têm menor energia que
separados.
Assim os átomos se ligam a fim de adquirirem estabilidade, pois quanto menor a energia maior a estabilidade.
ÁCIDOS, BASES E SAIS INORGÂNICOS
A reação de um ácido com uma base para produzir sal e água é chamada reação de neutralização
.
.
Ácidos
Ácidos têm sabor azedo.
Se íons hidrônio são encontrados em uma solução, a solução
é ácida em natureza. Íons hidrônio (ou hidroxônio) são os únicos íons
com carga positiva (cátions) formados quando um ácido é dissolvido em
água. Todas as propriedades de um ácido se devem à presença destes íons.
A fórmula química de um íon hidrônio é H3O1+.
Ácidos são conhecidos como 'doadores de prótons'.
Exemplos de Ácidos
Aqua Régia contém ácido Nítrico concentrado e ácido
Clorídrico concentrado na razão 1:3. Aqua Regia significa 'Água Real' em
Latim. Ela é usada para dissolver metais nobres como ouro e platina.
O leite contém ácido lático. Ácido lático é nomeado a partir da palavra em latim 'lac', que significa leite.
O vinagre é ácido acético bem diluído. O vinagre
utilizado para fins culinários contém aproximadamente 4% de ácido
acético. A fórmula química do ácido acético é CH3COOH.
O ácido sulfúrico é usado na manufatura de baterias de carro.
Ele também é conhecido como 'Óleo de Vitriol'. A fórmula química do ácido sulfúrico é H2SO4.
O ácido carbônico é responsável pelo gás nos
refrigerantes. O ácido carbônico se decompõe em bolhas de dióxido de
carbono. A fórmula química do ácido carbônico é H2CO3.
Ácido Ascórbico é o nome químico da Vitamina C. Deficiência de Vitamina C no organismo pode causar uma doença chamada escorbuto. A fórmula química do ácido ascórbico é C6H8O6.
Bases
Bases têm sabor amargo e são semelhantes ao sabão quando as tocamos.
Se íons hidroxila são encontrados em uma solução, a
solução é básica em natureza. Íons hidroxila são os únicos íons com
carga negativa (ânions) formados quando uma base é dissolvida em água.
Todas as propriedades de uma base se devem à presença destes íons. A
fórmula química de um íon hidroxila é OH1-.
Bases são conhecidas como 'aceitadoras de prótons'.
Exemplos de Bases
Anti-Ácidos ajudam a neutralizar a acidez (do ácido
clorídrico) no estômago. Eles geralmente contêm duas bases, chamadas
hidróxido de magnésio e hidróxido de alumínio. A fórmula química do
hidróxido de magnésio e hidróxido de alumínio é Mg(OH)2 e Al(OH)3 respectivamente.
Hidróxido de Sódio é também conhecido como 'Soda Cáustica'. Sua fórmula química é NaOH.
Hidróxido de Potássio é também conhecido como 'Potassa Cáustica'. É usado na manufatura de baterias alcalinas. Sua fórmula química é KOH.
Amônia é um gás básico o qual é usado na manufatura de
fertilizantes como a Uréia, nitrato de amônio e sulfato de amônio. A
amônia é produzida para fins comerciais através do processo de Haber.
Quando dissolvida em água, a amônia forma uma base conhecida como
hidróxido de amônio. A fórmula química da Amônia é NH3.
Sais
Um sal é definido como um composto formado pela substituição
completa ou incompleta do íon hidrogênio de um ácido por um radical
básico.
Um sal normal é formado pela substituição completa do íon hidrogênio de um ácido por um radical básico enquanto um sal ácido é formado pela substituição incompleta do íon hidrogênio de um ácido por um radical básico.
Exemplos de Sais
Sulfato de Sódio é um sal normal enquanto Bisulfato de Sódio é um sal ácido.
Cloreto de Sódio é solúvel em água enquanto o Carbonato de Cobre, Cloreto de Chumbo e Sulfato de Bário são insolúveis em água.
Carbonato de Sódio é usado na manufatura de detergentes e do vidro comum.
Sulfeto de Zinco é insolúvel em água enquanto Fosfato de Potássio, carbonato de Amônio e Cloreto de Bário são solúveis em água.
Nitrato de Amônio é usado na fabricação de fertilizantes.
Referências: http://br.syvum.com/cgi/online/serve.cgi/materia/quimica/acids_bases_salts.html
Assinar:
Postagens (Atom)







.jpg)